代写计算机硕士论文题目:基于异质图学习的药物副作用聚类探讨

本文是一篇计算机硕士论文,本研究围绕药物副作用的多组学异质网络分析,系统性地提出了一套融合异质图神经网络与多模态聚类算法的创新性研究框架。
1绪论
1.1课题研究背景及研究意义
药物发现与设计是耗资大、周期长、风险高、成功率与效率低的系统工程[1],新药的研发全过程如图1-1所示。据统计,一个新药从初始概念到投放市场平均耗时10~15年,平均花费是8~15亿美元,尽管如此,每年也仅有约10%药物获得美国食品和药物管理局(food&drug administration,FDA)认证[2-4]。2013年之前,每年被该机构认证的新药约20种[5]。如果是癌症药物,其花费更高,达到10-20亿美元,但是仍有90%以上的化合物无法通过临床检验[6]。
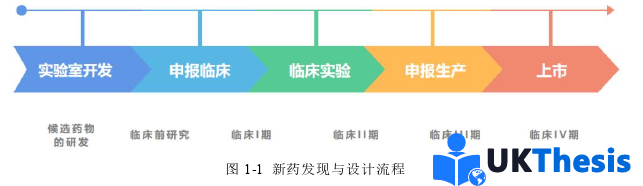
药物不良反应(Adverse Drug Reactions,ADRs)是指在正常用药过程中出现的有害非预期反应[7],其导致超过20%的临床试验失败,并被视为现代药物研发过程中的主要负担[8,9]。严重的药物不良反应可能导致患者重度残疾甚至死亡。在欧洲,约3.6%的住院病例由ADR引起,且高达10%的住院患者曾经历ADR[9]。在美国,估算数据显示每年住院患者中发生超过200万例严重ADR,并导致10万人以上死亡[10,11]。2016年,美国因药物相关疾病造成的年度经济成本估计达5284亿美元,相当于当年全美医疗总支出的16%[12]。药物不良反应引发的药物临床试验失败主要原因是药物在临床应用前需经过动物实验和大批量人体临床试验以识别潜在不良反应;然而,由于上市前试验的样本量有限、试验周期不足,以及众多可能的副作用和药物组合,许多不良反应在药物研发早期阶段难以被发现[13]。
1.2国内外研究现状
在提高异质图神经网络算法的改进与应用和聚类算法的性能方面,许多国内外学者一直以来坚持不懈的做着研究工作。与本文工作相关的国内外研究现状一共分为以下两部分:异质图神经网络算法的国内外研究现状以及聚类分析技术的国内外研究现状。
1.2.1异质图神经网络算法研究现状
复杂系统中的许多现实数据天然适合用异质图表示,其中多种类型的实体及其关系分别体现为不同类型的节点和边[24]。
异质图(heterogeneous graph)通过多类型节点和边揭示了其蕴含的语义信息。过去十年间,异质图学习获得了广泛关注。早期研究通常结合skip-gram模型[25]和元路径引导的随机游走[26-28]。随着深度学习的快速发展,图神经网络(GNNs)[29-31]被提出以融合节点特征并受益于神经网络架构。最初GNNs专注于同质图,但研究者很自然地将GNNs推广到异质场景,其中多种类型的节点和边为GNN设计引入了额外的复杂性。
而后,多种异质图神经网络(HGNNs)已被提出用于捕捉语义信息,在异质图表征学习方面取得了卓越性能[32-36]。HGNNs是众多应用领域的核心,包括社交网络分析[37]、推荐系统[38,39]和知识图谱推理[40-42]。
2研究路线及相关技术
2.1研究路线
本研究的技术路线遵循“数据整合→特征学习→聚类验证”的递进逻辑,各环节通过生物医学问题驱动形成紧密闭环,具体流程如图2-1所示。
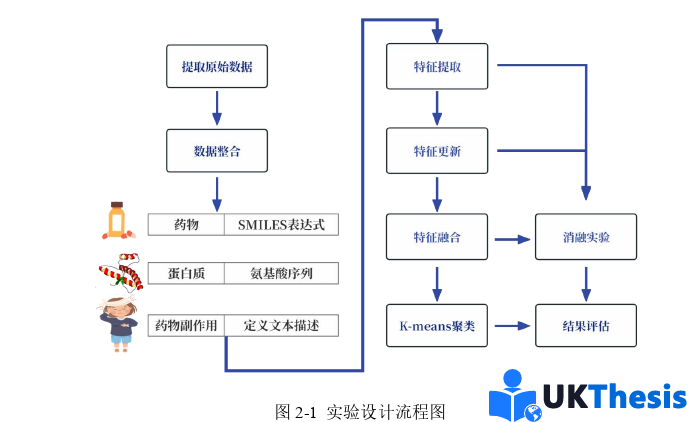
研究起始于多源数据的系统性整合:从DrugBank[101]、HuRI[102]、SIDER[103]三大数据库提取原始数据后,通过第三方数据库构建不同数据库间实体映射关系,构建涵盖药物、蛋白质、副作用的异质网络,该网络包括药物-药物、药物-蛋白质、药物-副作用及蛋白质-蛋白质四种不同互作关系。此阶段通过数据清洗(如过滤无效副作用)从源头保障了后续分析的可靠性,同时通过标识符统一(如PubChemCID构建DrugBank、SIDER数据库间药物不同标识符映射关系)解决了多组学研究中的“数据孤岛”难题,为异质图构建奠定了基础。
2.2图机器学习理论
2.2.1同质图神经网络
在传统同质图分析方法中,图神经网络(Graph Neural Networks,GNN)已成为最主流的解决方案。这类网络架构专为处理具有图结构的数据而设计[109]。现实世界中的诸多复杂系统,包括社交关系网、药物相互作用网以及分子化学结构等,均可建模为图数据结构,其中节点代表每个系统的基本组成单元,边则代表基本单元间的相互作用关系。GNN的核心价值在于其能够有效捕捉顶点间的非线性关联以及图的整体拓扑特征[109]。该技术通过节点嵌入机制实现这一目标,其中每个节点的特征向量都是通过聚合其相邻节点的信息而生成的,这种局部信息融合策略使得每个节点都具有其局部网络结构的特性[109]。通过多轮迭代优化,节点的特征嵌入会逐步整合更广泛邻域空间的信息,最终形成能够反映其在全局网络中拓扑结构的高维特征向量。
图神经网络的核心是通过消息传递机制(Message Passing)实现节点特征学习。其框架可分为四个关键步骤:
GNN专为处理仅含单一类型节点和边的同质图而设计,采用邻域聚合机制来获取图结构信息——通过递归聚合相邻节点特征的方式来计算每个节点的特征嵌入。然而,GNN难以有效处理兼具丰富语义信息和结构信息的异质图。由此,异质图神经网络相关算法不断出现。异质图神经网络(Heterogeneous Graph Neural Network)与同质图神经网络最大区别在于异质图中包含节点异质性和关联多样性。
3基于药物多组学异构网络的数据整合与特征对齐研究......................27
3.1引言................................27
3.2药物多组学异构网络标准数据集........................28
4基于Bi-LSTM和RWR交叉注意力的药物副作用聚类分析算法..........................38
4.1基本思路...................................38
4.2基于Bi-LSTM的特征学习.............................39
5基于元路径注意力机制的药物副作用聚类分析方法..........53
5.1基本思路...............................53
5.2元路径设计.................................54
5基于元路径注意力机制的药物副作用聚类分析方法
5.1基本思路
本研究在异质图神经网络的特征学习方面提出了两种不同逻辑的方法体系,形成全面的技术探索。
在第四章中,创新性地将异质图信息解构为三个关键维度:通过Bi-LSTM捕捉同种节点间的序列依赖关系,利用注意力机制建模不同节点类型的语义交互,并引入随机游走重启策略提取网络的拓扑结构特征。这三个维度的特征通过交叉注意力机制进行深度融合,其中转移概率矩阵作为图结构的先验知识指导特征聚合过程。消融实验证实,这种基于关系的学习框架中每个模块都对最终聚类性能具有显著贡献。
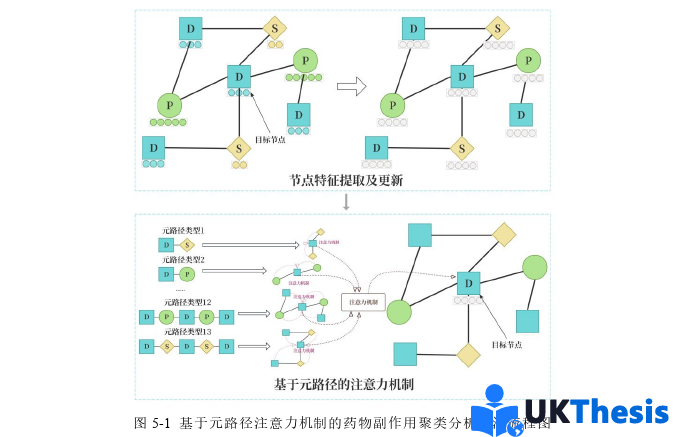
第五章则转向基于元路径的异质图学习方法,与第四章形成方法论的对比研究。具体而言,在第三章通过自然语言处理的方式提取异质节点各自生物信息学特征并进行维度统一处理的基础上,本章首先将异质节点构建为异质图,随后基于领域知识设计关键元路径,在每条元路径上采用图注意力机制进行邻域特征聚合,获得路径特定的节点表示。随后通过元路径级别的注意力层,动态学习不同语义路径的重要性权重,最终生成融合多路径信息的节点嵌入。这种分层注意力架构(节点级+路径级)能够自适应地捕捉异质图中复杂的语义关联,如图5-1所示。
6总结与展望
6.1工作总结
本研究围绕药物副作用的多组学异质网络分析,系统性地提出了一套融合异质图神经网络与多模态聚类算法的创新性研究框架。在方法学层面,本研究的主要贡献体现在三个关键环节:
在数据整合与特征工程方面,通过构建药物-蛋白质-副作用三元异质网络,创新性地解决了多源生物医学数据的标识符异构性问题。研究采用Drug-smile-fet模型、3-gram蛋白质序列分析和sentence-BERT文本嵌入等技术,实现了跨模态特征的深度语义提取,并通过去噪自编码器(DAE)完成了特征空间的统一对齐,为后续分析提供了高质量的多维特征表示。
在异质图特征学习方面,本研究提出了两种不同的技术路线:第四章中使用的Bi-LSTM与RWR注意力机制融合模型,有效整合了序列特征与拓扑结构信息;第五章设计的基于元路径的异质图神经网络,则通过分层注意力机制捕捉高阶语义关联。两种方法分别从局部互作和全局路径的角度,为药物副作用分析提供了多维度的特征表示。
在聚类分析环节,尽管药物副作用缺乏合适的真实标签,在研究中仍然通过肘部法则与多指标验证确定了最优聚类方案。消融实验结果表明,本研究提出的框架在内部评价指标上取得显著提升,且聚类结果展现出良好的生物学可解释性,为药物安全预警和副作用机制研究提供了新的分析工具。
本研究的创新价值不仅体现在具体的技术改进,更重要的是建立了一套可扩展的药物多组学分析范式,为后续研究提供了方法论参考。未来工作可进一步拓展到药物重定位、多药联用安全性评估等应用场景。
参考文献(略)