医学类硕士论文范文代写:罗哌卡因脂质体的制备及抗肿瘤活性探讨

本文是一篇医学类硕士论文,本研究突破传统局麻药单模态镇痛的技术局限,开发了基于脂质体载体的罗哌卡因缓释系统。实现药物在肿瘤部位的被动靶向富集(EPR效应)与缓释。在保障围术期镇痛需求的同时,显著提升肿瘤局部药物浓度。实现了精准麻醉与抗肿瘤治疗的双重功能。
1围手术期麻醉管理对肿瘤转移和复发的影响
1.1手术对肿瘤转移和复发的影响
手术是实体瘤患者的主要治疗手段,其本身具有双重效应:一方面能够切除原发灶,另一方面可能通过多重机制促进肿瘤复发和转移,进而增加发病率和死亡率[11]。从生物学机制来看,手术操作中的机械牵拉可直接导致循环肿瘤细胞(CirculatingTumor Cells,CTCs)播散[12,13]。同时手术创伤应激会激活下丘脑-垂体-肾上腺轴(HPA),引发皮质醇、前列腺素E2(Prostaglandin E2,PGE2)等免疫抑制因子释放,打破Th1/Th2免疫平衡并抑制自然杀伤细胞(NK细胞)活性,形成利于残留癌细胞免疫逃逸的微环境[14]。而CTCs在多数实体肿瘤患者中均可检测到,且其数量升高与多种肿瘤类型的不良预后密切相关[15]。
肿瘤细胞的播散可通过血液、淋巴或经体腔(一种跨越体腔或器官表面包括胸膜或腹膜表面的肿瘤转移途径)途径发生。使用实时荧光成像已经观察到肿瘤细胞可通过手术破坏淋巴管播散[16]。临床前研究表明,肿瘤间质高压环境通过促进淋巴引流加速癌细胞转移,该过程可被手术创伤引发的炎症级联反应显著放大:手术造成的血管内皮损伤导致间质静水压异常升高,引发间质水肿并增强残余肿瘤细胞的淋巴迁移能力[17]。而在腹腔手术中,消化道及妇科恶性肿瘤(结直肠/胰腺/卵巢癌)在腹腔手术后更易发生体腔种植转移,临床前模型证实该机制促进腹膜转移灶形成[18]。此外,手术过程中二氧化碳气腹(用于辅助腹腔镜手术)导致的干燥作用可能进一步加速肿瘤的腹腔扩散[19],其手术操作本身也可能直接诱发肿瘤细胞播散。例如,使用腹腔镜端口可能导致端口部位复发:在胃肠道[20]及泌尿系统[21]等恶性肿瘤术后均有出现。且在意外诊断的胆囊癌切除术患者中,其发生率超过10%[22]。
1.2麻醉对肿瘤转移和复发的影响
肿瘤治疗的围手术期管理中,麻醉策略作为核心要素通过双重机制影响肿瘤进程:其作用不仅限于缓解手术创伤,更关键的是调控“肿瘤侵袭潜能-宿主免疫屏障”动态平衡系统。研究表明,特定麻醉药物及技术方案通过调节循环肿瘤细胞活性和重塑免疫微环境等方式直接干预微转移。
在临床麻醉中,吸入麻醉药(如七氟醚、异氟醚、地氟醚)与静脉麻醉药丙泊酚对肿瘤生物学行为的影响已获得多维度证据支持。研究显示吸入麻醉药可通过调控IL-17和TNF信号通路及其相关转录因子促进肿瘤转移,其应用还与皮质醇及促肾上腺皮质激素水平升高存在关联[38],并通过抑制Mac-1、Ras相关蛋白1(Ras-relatedprotein 1,Rap1)和TLR4等分子显著削弱中性粒细胞的吞噬功能[39]。与丙泊酚联合区域阻滞技术相比,接受吸入麻醉患者的术后血清显示出更强的肿瘤细胞活性刺激作用及NK细胞活性抑制效应。尽管挥发性麻醉剂通过诱导HIF-1a表达对缺血再灌注损伤具有保护作用,但在肿瘤手术中可能增加恶性复发风险,特别是在前列腺癌和肾细胞癌中,异氟烷介导的缺氧诱导因子(Hypoxia-Inducible Factor,HIF)表达上调与癌细胞迁移增殖密切相关[40]。相比之下,丙泊酚作为主流静脉麻醉药展现出潜在抗肿瘤特性。其抗炎作用与免疫激活效应可能通过多种机制实现:在乳腺癌手术中促进肿瘤微环境内NK细胞和辅助性T细胞浸润[41]、维持术后血清中NK细胞活性水平[42]。分子机制研究揭示丙泊酚可抑制NET1、SOX4等促癌基因表达,降低前列腺癌细胞雄激素受体表达,并通过下调HIF-1a抑制肿瘤血管生成[40,43]。不过现有研究结论尚未形成统一共识,其临床获益仍需通过前瞻性研究进一步验证。
2实验方法
2.1溶液配制
2.1.1 1mg/mL的IR780溶液
使用分析天平(精度0.001 mg)准确称取IR780粉末,溶于氯仿中,制备成浓度为1 mg/mL的母液。将混合液转移至数控超声清洗机中,以40 kHz频率超声30分钟,确保染料充分溶解并分散均匀。溶液转移至棕色样品瓶后,采用封口膜密封,外层包裹锡纸以隔绝光线,最终于4℃冷藏保存备用。
2.1.2 PBS缓冲液
准确称取0.01 M磷酸盐缓冲液粉末,溶解于150 mL去离子水中,磁力搅拌至完全溶解后定容至200 mL,获得10×PBS浓缩液。取20 mL 10×PBS母液,加入180mL去离子水混合均匀,静置10分钟以获得渗透压稳定的1×PBS溶液。将1×PBS溶液分装至无菌样品瓶,经121℃高压蒸汽灭菌15分钟,密封后标记配制日期。避光条件下,保存于4℃冰箱。
2.1.3完全培养基
在超净工作台内,向预热至37℃的DMEM基础培养基中依次加入体积分数10%的胎牛血清(FBS)、1%HEPES缓冲液、1%L-谷氨酰胺及0.5%青霉素-链霉素双抗(A/P,100×储存液)。采用移液器轻柔吹打10次(避免气泡产生),使各组分充分混合,密封后置于4℃避光保存。
2.2纳米粒子的制备
2.2.1空载脂质体的制备
精确称取卵磷脂(160 mg)与胆固醇(20 mg)(质量比8:1),溶解于氯仿-无水乙醇混合溶剂(1:1,v/v,40 mL)中。将混合液转移至100 mL圆底烧瓶,经辅助超声处理(40 kHz,15 min)实现脂质分子均质分散。随后采用旋转蒸发仪(40℃,80rpm)减压旋蒸40 min,待溶剂完全挥发后形成乳白色脂质薄膜。向烧瓶内注入10 mL超纯水,于45℃恒温水浴中超声水化10 min(功率80 W),促使脂质薄膜脱落并分散均匀,将粗悬液转移至冰浴预冷的50 mL离心管,采用探头式超声细胞破碎仪以脉冲模式(工作4 s/间歇3 s)处理30 min,全程维持体系温度≤10℃。超声处理后悬液经4000 rpm离心10 min,有效去除钛合金探头磨损产生的金属碎屑及未包封脂质碎片。收集上清液(即空载脂质体)。
2.2.2 R@L的制备
将Rop溶液(浓度0.5%)作为水化介质替代超纯水,参照上述Lip制备流程,最终获得R@L溶液。
2.2.3 RI@L的制备
在R@L合成初始阶段,向含脂质薄膜的圆底烧瓶中共注入1 mL IR780氯仿溶液(1 mg/mL),形成IR780-脂质分子共混体系。采用避光共包埋策略(全程锡纸覆盖反应容器),然后再按照上述Lip制备流程,即可得到RI@L溶液。将其外层以锡纸避光包裹,于4℃冷藏保存。
3 统计学方法................................. 27
4 技术路线图................................... 28
5 实验结果 ............................... 29
5.1 纳米粒子的表征研究 ............................... 29
5.2 RI@L的体外释药研究 ................................... 32
5.3 RI@L的体外荧光成像及光热性能研究 ............ 34
6讨论
6.1脂质体的特征
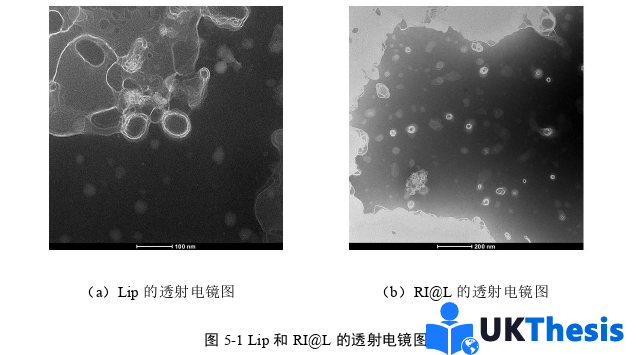
脂质体粒径作为关键参数,在抗肿瘤药物递送中具有双重调控作用:影响肿瘤组织的靶向蓄积效率的同时,又决定体内循环特性。研究证实,粒径参数通过以下机制发挥核心调控功能:首先,粒径大小直接关联肿瘤血管穿透能力[105],其次,与血液循环持续时间共同决定肿瘤组织的最终蓄积水平[106]。脂质体化抗肿瘤药物的疗效与毒性特征均呈现显著的粒径依赖性;当粒径小于100 nm时,循环时间缩短主要源于肝血窦毛细血管(平均孔径100 nm)对小粒径载体的高通透性,导致肝实质细胞摄取增加[107]。当粒径超过100 nm时,肝脾吞噬系统的快速清除成为主导因素[108]。Liu团队在EMT6(小鼠乳腺癌细胞系)肿瘤模型中系统揭示了粒径-蓄积的量化规律:90-200 nm粒径范围的脂质体可能同时具备最优肿瘤蓄积量和血液长循环特性,证实循环持续时间与肿瘤蓄积效率存在直接正相关[108]。载体表面特性需协同满足两大要求:通过构建亲水性中性及弱负电界面降低血浆蛋白吸附,延缓巨噬细胞吞噬[109]。通过弱负电或适度正电修饰减少与负电性生物界面的电荷排斥[110],此发现为表面电荷调控提供了重要理论依据。而本课题所制备的RI@L粒径在Pbs及10%FBS中均能稳定在200 nm以内,且表面带有少量负电荷,兼具血液长循环与肿瘤靶向蓄积的结构基础。此外,通过透析法测得药物在体外稳定缓慢释放,直至24 h左右实现完全释放,证明其具有优异的缓释效果。
结论
1、成功制备了Rop&IR780@Lip脂质体,粒径约为150 nm,并具有良好的稳定性。
2、合成的Rop&IR780@Lip脂质体细胞毒性低、溶血率极低、在体内和体外均具有良好的生物相容性。
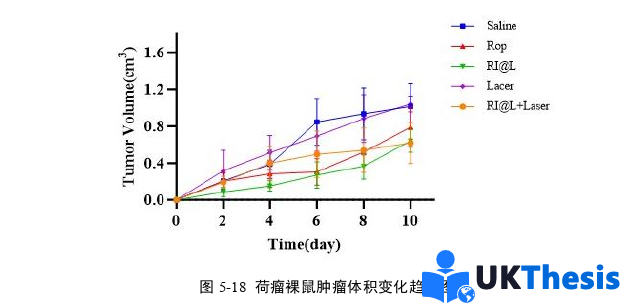
3、本研究构建的Rop&IR780@Lip纳米递送系统通过EPR效应实现肿瘤靶向富集,具有一定的抗肿瘤活性。
4、本研究结果为围术期精准实施区域神经阻滞联合肿瘤微环境调控提供了参考,其镇痛-抗肿瘤协同效应有望为麻醉方案的选择提供一定指导。
参考文献(略)